Décrypter la phosphorylation des canaux sodiques cardiaques : un travail d’orfèvre !
Après un doctorat à l’institut du thorax de l’Université de Nantes et un post-doctorat à Saint-Louis dans le Missouri aux Etats-Unis, Céline Marionneau a rejoint l’institut du thorax en 2009, et a été recrutée en tant que Chargée de Recherche au CNRS en 2010 au sein de l’équipe « Canaux ioniques et arythmies cardiaques« . Spécialiste en électrophysiologie cardiaque, elle met à profit son expertise en protéomique* afin de caractériser les mécanismes de régulation des canaux sodiques cardiaques par la phosphorylation.
Son objectif ? Localiser l’ensemble des sites de phosphorylation du canal sodique cardiaque, et décrypter leurs rôles dans la régulation de l’activité électrique cardiaque. Le point de mire de ses travaux étant de déterminer les rôles potentiels de ces sites de phosphorylation dans la pathologie, en particulier dans la survenue des arythmies cardiaques.
Lauréate de trois financements de la Fondation Genavie, en 2013, 2014 et 2019, Céline nous décrit ici son projet de recherche autour de la phosphorylation du canal sodique cardiaque, qu’elle développe à l’institut au sein d’une équipe de doctorants et d’ingénieurs, et qui réunit aussi plusieurs experts scientifiques internationaux.
Le canal sodique est une protéine localisée dans la membrane plasmique des cellules cardiaques qui joue un rôle majeur dans la génération et la régulation de l’activité électrique cardiaque. Il participe à la génération de l’influx électrique qui nait spontanément dans le cœur et se propage dans tout le muscle cardiaque afin de permettre sa contraction coordonnée et l’éjection du sang dans l’organisme. Plus précisément, le canal sodique permet l’entrée de sodium dans la cellule pour initier chaque battement cardiaque.
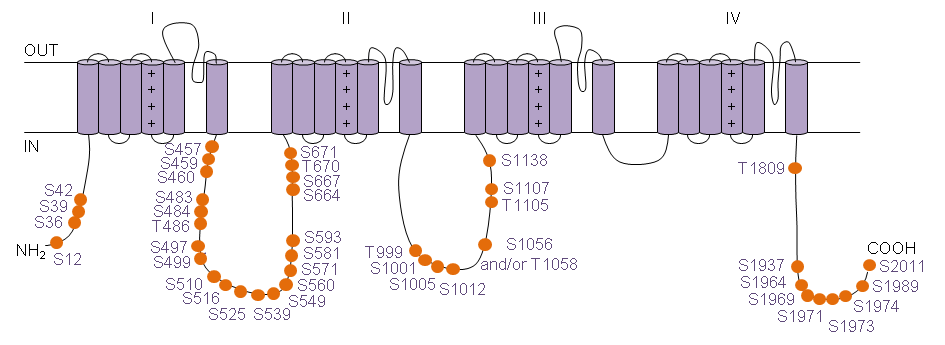
par spectrométrie de masse (d’après Lorenzini et coll, Journal of General Physiology, 2021).
Le fonctionnement du canal sodique est complexe : il s’ouvre, il s’inactive, et se ferme à des moments bien précis au cours de chaque battement cardiaque, et ces mécanismes sont finement régulés au sein de complexes protéiques macromoléculaires dans la membrane plasmique des cellules cardiaques. Ces complexes canalaires comprennent de nombreuses protéines partenaires et régulatrices, dont des enzymes, appelées les kinases, capables d’ajouter des groupements phosphates sur des sites bien spécifiques du canal : les sites de phosphorylation. « Ces phosphorylations vont changer la structure et ainsi le fonctionnement du canal, et participer très finement à la régulation de l’activité électrique cardiaque. Ces changements de phosphorylation interviennent aussi dans des contextes pathologiques, et plusieurs équipes, dont la nôtre, ont montré le rôle de ces changements dans la survenue d’arythmies cardiaques » précise Céline.
Bien que diverses études réalisées dans plusieurs laboratoires internationaux aient suggéré l’existence de quelques sites de phosphorylation sur le canal sodique cardiaque, leur existence dans le cœur et leurs rôles dans la régulation du canal demeuraient très largement inconnus. C’est la raison pour laquelle Céline a entrepris des études visant à identifier ces sites de phosphorylation à partir de cœurs de souris, et plus récemment à partir de prélèvements cardiaques humains, et à caractériser leurs rôles fonctionnels dans les cellules cardiaques.
Les deux premiers financements que Céline a obtenus de la fondation Genavie, en 2013 et 2014, lui ont permis d’identifier une vingtaine de sites de phosphorylation sur le canal sodique cardiaque et de caractériser les rôles fonctionnels de deux d’entre eux (Marionneau et coll, Journal of Proteome Research, 2012 ; Burel et coll, Journal of Biological Chemistry, 2017). Pour cela, Céline a développé une expertise unique qui consiste à purifier les canaux sodiques à partir de cœurs de souris et à identifier les protéines partenaires/régulatrices du complexe canalaire et les sites de phosphorylation de ces protéines par spectrométrie de masse*. Ces dernières années, la sensibilité accrue de cette technologie lui a permis d’augmenter le nombre de sites identifiés à une quarantaine, ce qui a révélé, pour la première fois, que le canal sodique cardiaque est une protéine hyperphosphorylée (Lorenzini et coll, Journal of General Physiology, 2021). Ce travail minutieux et coûteux a demandé à Céline beaucoup d’optimisations techniques, ce qui l’a conduit à devenir une des rares expertes au monde dans ce domaine.
Il lui faut aujourd’hui comprendre les rôles fonctionnels de chacun de ces sites de phosphorylation, complexifiant encore plus ses investigations. En effet, plusieurs analyses lui ont permis de comprendre que ces sites n’agissent pas seuls, mais plutôt en groupe de sites dispersés sur le canal, et qu’il était en conséquence impossible de prédire les combinaisons de sites phosphorylés ainsi que leurs rôles dans un contexte particulier.
C’est la raison pour laquelle Céline a décidé d’aborder ses nouveaux projets de recherche de manière ciblée, c’est-à-dire dans le contexte de régulations physiologiques ou physiopathologiques bien spécifiques. Elle a choisi de commencer par la régulation β-adrénergique*, qui joue un rôle central non seulement dans les conditions physiologiques (c’est elle qui accélère le cœur et augmente sa force de contraction lors de l’effort physique ou le stress par exemple), mais aussi dans de nombreuses pathologies cardiaques héréditaires ou acquises où elle est souvent le déclencheur des arythmies.
Ce nouveau projet a été amorcé au laboratoire grâce à un financement de la fondation Genavie !
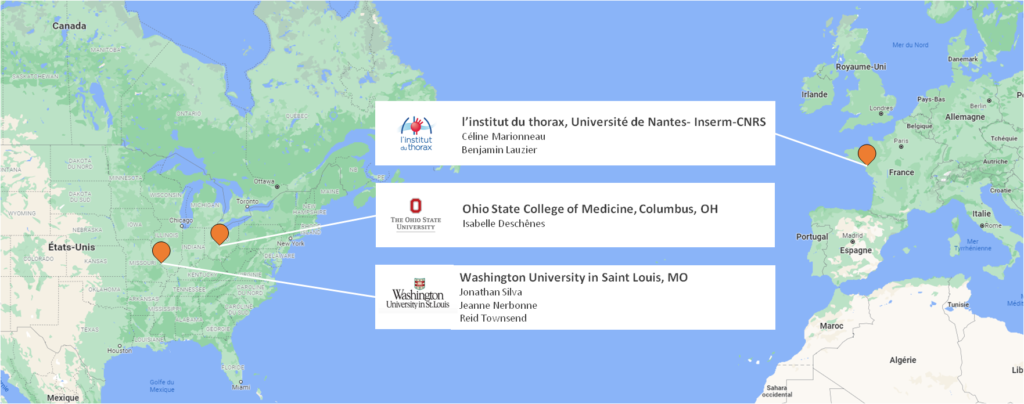
Il s’agit d’un projet collaboratif, au sein de l’institut avec Benjamin Lauzier, Maître de Conférences à l’Université de Nantes, mais aussi à l’international, avec quatre laboratoires américains, ce qui permet à Céline de rassembler l’ensemble des expertises nécessaires au développement du projet.
L’objectif de ce projet consiste à identifier les sites de phosphorylation activés en réponse à une stimulation β-adrénergique, et à caractériser leurs rôles dans la régulation du canal sodique cardiaque.
C’est un projet de longue haleine, nécessitant le développement de diverses approches, aussi bien en physiologie cardiaque (Benjamin Lauzier), en électrophysiologie cellulaire, biochimie et protéomique (Céline, et Isabelle Deschênes, Ohio State College of Medicine, Columbus, Ohio, USA), en spectrométrie de masse (Reid Townsend, Plateforme de Protéomique de la Faculté de Médecine de Washington University, Saint-Louis, Missouri, USA), et en biophysique et modélisation structurale (Jonathan Silva, Washington University). Ce projet requiert également l’accès et l’analyse protéomique de prélèvements cardiaques humains, ce qui est permis grâce à la participation de Jeanne Nerbonne (Faculté de Médecine de Washington University). L’amorçage de ce projet s’est par la suite concrétisé en 2020 par l’obtention, avec Jonathan Silva, d’un financement international prestigieux auprès du « National Institutes of Health » (NIH). Ce nouveau projet collaboratif international est un projet de médecine personnalisée visant à exploiter les sites de phosphorylation nouvellement identifiés dans le cadre du développement d’un test permettant de prédire la réponse des patients en insuffisance cardiaque à un traitement par la mexilétine, un anti-arythmique inhibiteur des canaux sodiques.
La fondation Genavie a donc contribué à trois reprises aux efforts de Céline, lui permettant ainsi de développer sa recherche malgré un contexte de financement de la recherche française difficile. Elle lui a ensuite permis d’amorcer un projet majeur dont les retombées, aussi bien fondamentales, c’est-à-dire pour la génération de nouvelles connaissances scientifiques, que cliniques, seront sans conteste importantes pour la communauté scientifique spécialisée en électrophysiologie cardiaque. Les résultats de ce dernier projet translationnel, actuellement développé par Céline et ses collaborateurs, devraient en effet permettre d’améliorer la prise en charge des patients présentant des arythmies associées à l’insuffisance cardiaque.
Définitions :
*La phosphorylation est une modification qui consiste en l’ajout d’un phosphate sur une protéine. Ce phosphate va modifier la structure, et donc le fonctionnement de la protéine.
*La protéomique consiste à étudier l’ensemble des protéines d’un organisme, d’un tissu biologique, d’une cellule ou d’un complexe de protéines.
*La spectrométrie de masse est une technique analytique très sensible permettant, entre autres, d’analyser la composition de molécules telles que les protéines.
*La régulation β-adrénergique dépend de la fixation de l’adrénaline et de la noradrénaline sur les récepteurs β-adrénergiques des cellules cardiaques. Cette fixation conduit, grâce à l’activation de nombreuses voies de signalisation intracellulaires, à l’accélération de la fréquence cardiaque et à l’augmentation de la contraction cardiaque.
Voici les articles scientifiques publiés par l’équipe, en lien avec ce projet :
Lorenzini M, Burel S, Lesage A, Wagner E, Charrière C, Chevillard PM, Evrard B, Maloney D, Ruff KM, Pappu RV, Wagner S, Nerbonne JM, Silva JR, Townsend RR, Maier LS, Marionneau C. Proteomic and functional mapping of cardiac NaV1.5 channel phosphorylation sites. Journal of General Physiology, 2021.
Burel S, Coyan FC, Lorenzini M, Meyer MR, Lichti CF, Brown JH, Loussouarn G, Charpentier F, Nerbonne JM, Townsend RR, Maier LS, Marionneau C. C-terminal phosphorylation of Nav1.5 impairs FGF13-dependent regulation of channel inactivation. Journal of Biological Chemistry, 2017, 292:17431-17448.
Marionneau C, Lichti CF, Lindenbaum P, Charpentier F, Nerbonne JM, Townsend RR, Mérot J. Mass spectrometry-based identification of native cardiac Nav1.5 channel a subunit phosphorylation sites. Journal of Proteome Research, 2012, 11:5994-6007.
Découvrez nos histoires de coeur : des projets scientifiques où le soutien de Genavie a joué un rôle clef :
Gap134 : une arme puissante contre la fibrose et la mort subite cardiaques. Mickaël Derangeon nous présente comment Genavie a permis de comprendre que la Connexine 43 avait un rôle essentiel dans le mécanisme délétère de la fibrose cardiaque, jusqu’à identifier Gap134 comme une molécule inhibant cette même fibrose. Découvrir le projet
Vers une nouvelle approche des canalopathies. La conception d’un médicament prend plus d’une dizaine d’années. Dans les labos de recherche, c’est similaire : des projets visant à mieux comprendre les mécanismes du vivant, les mécanismes d’une maladie et le développement de nouvelles thérapies s’étendent sur une, voire plusieurs décennies. C’est là que Genavie prend tout son sens en permettant des « soudures » entre deux financements. Lire l’article